
Thomas Duncan, PhD
CURRENT APPOINTMENTS
LANGUAGES
WEB RESOURCES
研究项目和附属机构
RESEARCH INTERESTS
F-type ATP synthases; bioenergetics of pathogenic bacteria; enzymology; structural biology, membrane protein function.
EDUCATION INTERESTS
Bioenergetics; mitochondria; lipid and cholesterol metabolism
ASSOCIATIONS / MEMBERSHIPS
EDUCATION
RESEARCH ABSTRACT
我的研究重点是f型ATP合酶的结构和功能, 一种能量转导酶复合物,对大多数生物的能量代谢至关重要. 我目前的重点是它在细菌代谢,毒力和发病机制中的关键作用. f型ATP合酶是在细菌的内细胞膜上组装的, 真核生物的线粒体内膜和叶绿体的类囊体膜(见“简单”细菌酶的例子), Fig. 1). 在氧化磷酸化和光磷酸化的最后一步, 它利用跨膜的能量, 质子的电化学梯度(质子动力), or pmf)来驱动大多数细胞ATP的合成. 然而,这种酶在本质上是可逆的,如果失去了呼吸的驱动力(如.g., lack of O2)或光合作用(黑暗),酶可以转变为水解细胞ATP,驱动质子(H+)以相反的方向在膜上运输并产生 pmf. 该酶对各种致病菌的生存能力和/或毒力至关重要, 其中一些依靠它来合成ATP,而另一些则只能将它作为ATP驱动的H+ pump. 尽管细菌和真核生物形式的酶在结构/功能上普遍保持一致, 贝达喹啉的开发证实了靶向这种酶攻击致病菌的潜力, 被发现是针对F分枝杆菌的OF1 目前被批准为三种药物的一部分, 治疗耐多药结核病的一线方案. 贝达喹啉是一种新的二芳基喹啉类抗生素中的第一种,对F分枝杆菌具有高度选择性OF1.

Fig. 1. Cartoon of E. coli FOF1 Architecture. 箭头下方的c环表示方向转子复合体(c10在ATP合成过程中,γε)在H+ transport.
BACKGROUND
ATP合酶由两个功能不同但耦合的亚复合物组成. 酶的基本结构以卡通形式显示在 Fig. 1 在大多数细菌中发现的最小亚基组成. The FO complex catalyzes H+ 转运并具有跨膜双层的亚基. F1 是一种延伸到水相的外周络合物,包含三个催化核苷酸结合位点,用于ATP的合成和水解. FO and F1 是通过两个茎状连接的子单元耦合的:一个中央转子轴和一个外围定子. 我和理查德·克罗斯的早期研究提供了关键的初步证据证明ATP合酶的能量耦合涉及
- 中心轴在F内的旋转1 协调三个合作的,交替的催化核苷酸位点的作用,和
- Rotation of subunits within FO 在能量驱动的质子传输过程中.
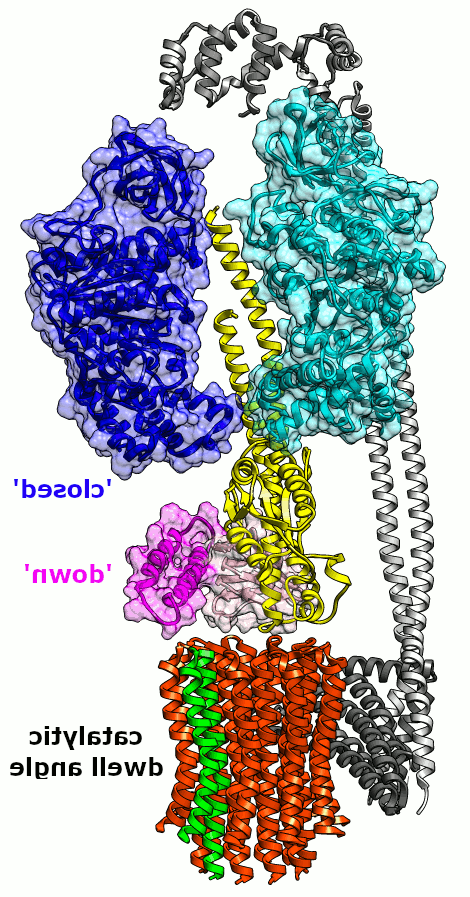
Fig. 2. Minimal E. coli FOF1 Animation. 一个β亚基的可能构象转变和相对于一个小(~36°)旋转子步的εCTD. 一个c亚基是绿色的,用来跟踪旋转 c-环沿转子轴转动 γ(黄色)和ε (NTD/CTD,粉色/品红). 只有1个β(青色)被显示出来,而中间的α亚基没有显示出来.
EXPERIMENTAL SYSTEMS & CURRENT PROJECTS
我们的研究长期使用来自E. coli, 这为这种旋转运动酶的结构/功能研究提供了一个简单而有力的模型. The E. 大肠杆菌系统允许直接的遗传筛选和ATP合成酶的工程, 以及F的大规模提纯OF1 and isolated, soluble F1 用于生物化学和结构研究. 我们继续发展更详细的知识 E. coli FOF1 了解εCTD的抑制机制,以及如何更好地靶向它来破坏细菌的生物能量学. 例如,我们正在与一位单分子显微镜专家合作, Dr. Michael Börsch (Jena University, 德国)利用荧光共振能量转移(FRET)研究了ε在单个EcF中的构象变化动力学OF1-liposomes.
Much less is known about FOF1 我们已经开始研究FOF1 in 2 distinct pathogens:
- Pseudomonas aeruginosa. This gram-negative, 机会致病菌是囊性纤维化患者持续肺部感染和死亡的主要原因. 它对免疫功能低下的人是一种重大危害,在医院获得性感染中很普遍. 耐多药菌株不断出现, in 2017, 世界卫生组织列出的碳青霉烯耐药性 P. aeruginosa 作为迫切需要开发新抗生素的三种病原体之一. P. aeruginosa 新陈代谢强烈依赖于呼吸,ATP合酶对其生存能力至关重要. 我们目前正在与 Christopher Nomura at neighboring SUNY-ESF and Guirong Wang (Upstate department of Surgery)研究(i) F的εCTD如何OF1 影响酶的功能 P. aeruginosa in vitro (ii) εCTD的破坏是否影响病毒的毒力或发病机制 P. aeruginosa 在培养的巨噬细胞和小鼠肺部感染模型中.
- Streptococcus pneumoniae. 这种革兰氏阳性病原体是细菌性肺炎的主要原因,但也可导致严重的侵袭性肺炎球菌疾病,如败血症和脑膜炎. 这种耐氧厌氧菌缺乏完整的呼吸链,因此不能利用FOF1 for significant ATP synthesis. Nevertheless, FOF1 is essential for S. pneumoniae’s 活力和耐酸性,作为atp酶驱动的H+ 泵通过细胞膜产生pmf并维持细胞pH稳态. 研究小组最近对小鼠败血症进行了研究 Marco Oggioni (英国莱斯特大学)的研究表明,肺炎球菌F具有重要的毒力作用OF1: subclones of S. 肺炎,出现建立败血症最常包含一个新生的错义突变基因的一个亚单位的FOF1 (2014, Gerlini et al., PLoS Pathogens, 10 e1004026). 相反,其中一个这样的毒性克隆在基因中发生了帧移突变 atpC ε基因打乱了ε ctd的序列, 这个肺炎球菌克隆在脾脏中显示出更高的存活率. They transferred that atpC mutation to a naïve, 非包封肺炎球菌菌株, 我们正在研究εCTD的破坏是如何影响F的OF1 在肺炎球菌膜中的功能.
SELECTED REFERENCES
T.M. Duncan (2019). 涡轮酶的结构瞄准了肺结核. Proc. Natl. Acad. Sci. USA 116, 3956-58. http://doi.org/10.1073/pnas.1900798116
M. Sobti, R. Ishmukhametov, J.C. Bouwer, A. Ayer, C. Suarna, N.J. Smith, M. Christie, R. Stocker, T.M. Duncan, A.G. Stewart (2019). 低温电镜显示不同的构象 E. coli ATP合酶对ATP的影响. eLife 8, e43864. http://doi.org/10.7554/eLife.43864
H. Sielaff, T.M. Duncan, M. Börsch (2018). The regulatory subunit ε in Escherichia coli FOF1-ATP synthase. Biochim. Biophys. Acta Bioenerg. 1859, 775-788. http://doi.org/10.1016/j.bbabio.2018.06.013
N.B. Shah, T.M. Duncan (2015). Aerobic growth of Escherichia coli 当从ATP合酶的ε亚基上删除五个c端残基时,ATP合成被选择性地抑制, J. Biol. Chem. 290, 21032-41. http://doi.org/10.1074/jbc.M115.665059
M. Börsch, T.M. Duncan (2013). 射灯电机和控制单FOF1-ATP synthase. Biochem. Soc. Trans. 41, 1219-26. http://doi.org/10.1042/BST20130101
N.B. Shah, M.L. Hutcheon, B.K. Haarer, T.M. Duncan (2013). F1-ATPase of Escherichia coli: ATP水解后形成ε-抑制态, 与adp抑制状态不同, 并对催化位点配体做出动态反应. J. Biol. Chem. 288, 9383-95. http://doi.org/10.1074/jbc.M113.451583
G. Cingolani, T.M. Duncan (2011). ATP合酶催化复合物的结构(F1) from Escherichia coli 自我抑制的构象. Nat. Struc. Mol. Biol. 18, 701-7. http://doi.org/10.1038/nsmb.2058
T.M. Duncan (2004). ATP合酶:旋转马达的部件和特性,见: The Enzymes, vol. 二十三:能量耦合与分子马达, vol. 23, (D.D. Hackney, F. Tamanoi, Eds.爱思唯尔学术出版社,纽约,第2页. 203-275.
M.L. Hutcheon, T.M. Duncan, H. Ngai, R.L. Cross (2001). 能量驱动亚基在亚基之间的界面旋转 a and the c oligomer in the FO sector of Escherichia coli ATP synthase. Proc. Natl. Acad. Sci.. USA 98, 8519-24. http://doi.org/10.1073/pnas.151236798
T.M. Duncan, V.V. Bulygin, Y. Zhou, M.L. Hutcheon, R.L. Cross (1995). 催化过程中亚基的旋转 Escherichia coli F1-ATPase. Proc. Natl. Acad. Sci. USA 92, 10964-68. http://doi.org/10.1073/pnas.92.24.10964
